Modernes Management der ovariellen Stimulation für IVF und ICSI

Die ovarielle Stimulation steht im Mittelpunkt der Behandlungsverfahren der modernen assistierten Reproduktion. Ziel ist es, möglichst viele und reife Eizellen für die Verfahren der
In-vitro-Fertilisation (IVF) mit oder ohne Anwendung der intracytoplasmatischen Spermieninjektion (ICSI) zur Verfügung zu stellen.
Während für den Eintritt einer Spontanschwangerschaft das Vorhandensein einer einzigen Eizelle ausreicht, ist es bei Einsatz der IVF sinnvoll, möglichst viele Eizellen zeitgleich zur Reife zu bringen. Die Schwangerschaftsrate steigt von 10 % auf über 25 %, wenn statt eines drei Embryonen übertragen werden können. Durch Einfrieren von befruchteten Eizellen im Pronucleus-Stadium stehen weitere potentielle Embryonen zur Verfügung, die in späteren Zyklen ohne erneute Stimulation übertragen werden können.
Physiologie der Eizellreifung im Normalzyklus
Im normalen Zyklus der Frau erfolgt die Rekrutierung der Eizellen, der sogenannten "Follikelkohorte", in der späten Lutealphase. Am dritten Zyklustag ist der Vorgang abgeschlossen. Bis zum 7. Zyklustag folgt die Selektion des sogenannten dominanten Follikels, der das Weiterwachstum der anderen Follikel hemmt und nur "seine" Eizelle zur Reife kommen lässt. Das weitere Wachstum des dominanten Follikels ist mit einem Anstieg der Östradiolkonzentration im Serum verbunden. Nach Erreichen der Follikelreife sorgen maximale Östradiolkonzentrationen über einen positiven Feedback-Mechanismus für eine schubartige LH-Freisetzung aus der Hypophyse. Dieser "LH-Peak" löst die 10 bis 12 Stunden später eintretende Ovulation aus.
Ovarielle Stimulation
Alle Schemata der ovariellen Stimulation basieren auf der direkten oder indirekten Erhöhung des FSH-Spiegels, um aus der rekrutierten Follikelkohorte statt eines eine Vielzahl von Follikeln zur Reife zu bringen (Abb. 1).
Die Stimulationsschemata der ersten Generation mit Clomifen und/oder der Kombination von humanem Menopausen-Gonadrotopin (HMG) und HCG haben den Nachteil, dass es unter der Stimulation häufig und nicht vorhersehbar zu einem vorzeitigen endogenen LH-Anstieg kommt (10 - 20 %). Die Stimulation muss dann abgebrochen werden, da die Follikel zum Zeitpunkt der Punktion schon spontan rupturiert oder überreif und in Degeneration begriffen sind. Das wirkt sich negativ auf die Oozyten und infolgedessen auch auf die Embryonenqualität und auf die Schwangerschaftsrate aus.

Durch gleichzeitigen Einsatz von GnRH-Analoga lässt sich der störende endogene LH-Anstieg verhindern. Die GnRH-Analoga haben als Releasinghormon-Agonisten zunächst eine erhöhte
Gonadrotopinausschüttung zur Folge ("Flare-up"-Effekt). Erst nach längerer Anwendung wird die Hyphophyse refraktär gegen GnRH und die Gonadrotopinspiegel sinken auf Null.
Die initiale Gonadrotopinausschüttung wird in den sogenannten kurzen Stimulationsprotokollen mitgenutzt zur Follikelstimulation.
Der GnRH-Agonist wird vom ersten Zyklustag an s.c. injiziert oder per Nasenspray verabfolgt. Vom vierten bis fünften Zyklustag an beginnt die FSH- (HMG-)Stimulation. Das HMG, das aus Menopausenurin gewonnen wird und sowohl FSH als auch das unerwünschte LH enthält, wird in jüngerer Zeit zunehmend durch hochgereinigtes oder durch rekombinantes FSH ersetzt.
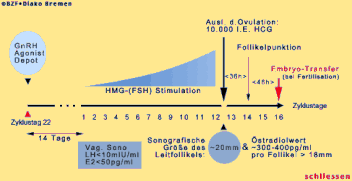
Die Ovulation wird mit 10.000 I.E. HCG ausgelöst, wenn der Leitfollikel sonographisch 20 mm mißt und der Östradiolwert 300 - 400 pg/ml pro Follikel beträgt. 36 Stunden später folgt die Follikelpunktion und im Falle der Fertilisation weitere 48 Stunden später der Embryotransfer. Beim ultrakurzen Protokoll wird die Gabe des GnRH-Agonisten auf die Zyklustage zwei, drei und vier begrenzt. Die Stimulation beginnt ab dem 3. Zyklustag. Ovulationsauslösung, Punktion und Embryotransfer erfolgen wie beschrieben.
Die Vorteile der genannten Protokolle liegen in der Kürze der Anwendung. Sie sind für die Patientin und das Behandlungszentrum zeitsparend und kostengünstig. Die kurzen Protokolle sollten nicht bei Frauen mit PCO-Syndrom (polyzystische Ovarien) und bei Frauen, die zur Überstimulation neigen, angewandt werden, da keine ausreichende Suppression der eigenen Gonadotropine erfolgt.

Bei kritischer Wertung scheint sowohl bei den Ergebnissen von prospektiven Studien, als auch in retrospektiven Auswertungen die Schwangerschaftsrate deutlich niedriger zu liegen (16 versus 25 %) als beim sogenannten "langen Protokoll". Das "lange Protokoll" ist das heute von den meisten Zentren bevorzugte Stimulationsschema.
Der GnRH-Agonist wird in der mittleren Lutealphase (Zyklustag 20) als Depot oder als tägliche subcutane Einzelinjektion oder nasal verabfolgt. Die FSH-Stimulation beginnt ca. 14 Tage später und wird je nach Wirkung (Größenwachstum der Follikel und Östradiolspiegel) langsam gesteigert. Die Ovulationsauslösung erfolgt wieder wie bei den anderen Protokollen, wenn die Grenzwerte von 20 mm Durchmesser des führenden Follikels und 300 - 400 pg/ml 17Beta-Östradiol pro reifem Follikel erreicht sind. Der Vorteil des langen Protokolls besteht in der besseren Steuerbarkeit und Synchronisation des Follikelwachstums, verbunden mit einer besseren Eizell- und Embryonenqualität.
Trotz etwas aufwendigerem Stimulationsprocedere und höheren Arzneikosten hat sich das "lange Protokoll" aufgrund der höheren Erfolgsrate als Standardverfahren durchgesetzt.
Lutealphasenunterstützung
Besonders nach dem "langen Protokoll" muss die Lutealphase nach dem Embryonentransfer gestützt werden, da die hypophysäre LH-Sekretion blockiert bleibt. Die Folge ist eine vorzeitige Luteolyse mit nachfolgendem Progesteronmangel und mangelhafter sekretorischer Umwandlung des Endometriums.HCG-Injektionen am zweiten und fünften Tag nach der Follikelpunktion fördern die Progesteronsynthese im Gelbkörper und führen zu höheren Schwangerschaftsraten. Zusätzlich oder alternativ werden über 14 Tage dreimal täglich 200 mg Progesteron als Vaginaltablette verabfolgt.
Komplikation - Ovarielles Hyperstimulationssyndrom (OHSS)
In 5 bis 15 Prozent der Fälle entwickelt sich nach der ovariellen Stimulationsbehandlung ein OHSS. Die Ursache ist bis heute nicht eindeutig geklärt. Eine Häufung findet sich bei Frauen mit PCO-Syndrom und in Fällen eines besonders guten Ansprechens auf die Stimulationstherapie, erkennbar an Östradiolwerten über 5000 pg/ml und über 15 reifen Follikeln zum Zeitpunkt der Follikelpunktion. Dem HCG scheint in der Genese des OHSS eine Schlüsselfunktion zuzukommen. Bei eingetretener Schwangerschaft, d.h. bleibend hohen HCG-Spiegeln, ist die Erkrankungsdauer entsprechend protrahiert. Bei schwerer Ausprägung kommt es zu extremen Flüssigkeitsverschiebungen ins zweite und dritte Kompartiment mit Aszites und Hydrothorax und nachfolgender Hämokonzentration und Verschiebungen im Elektrolythaushalt. Klinisch stehen der Bauchschmerz und gastrointestinale Symptome wie Übelkeit, Erbrechen und Durchfall sowie ein ausgeprägter Meterorismus im Vordergrund. Leichte Verlaufsfolgen können ambulant behandelt werden, die mittelschwere und schwere Verlaufsform müssen stationär behandelt werden, um schwere thromoembolische Komplikationen und Entgleisungen des Elektrolythaushaltes zu verhindern. Das therapeutische Ziel besteht in der Wiederherstellung der Kreislauffunktionen durch Flüssigkeitssubstitution, wobei ein Hämatokrit von unter 40 % angestrebt werden sollte. Gleichzeitig werden die Elektrolyte ausgeglichen. Die Thromboseprophylaxe erfolgt mit 2 x 5000 IE Heparin s.c.. Zusätzlich erfolgt eine symptomatische Schmerztherapie. In seltenen Fällen ist eine Aszites-Punktion erforderlich.
Zusammenfassung
Der assistierten Reproduktion steht heute ein modernes Armentarium zur Verfügung, um die Eizell-Reifung im Rahmen der künstlichen Befruchtung zu induzieren und zu vervielfachen. Bei kenntnisreicher Anwendung lassen sich hohe Schwangerschaftsraten erzeugen. Bei vermeintlich hohen Kosten für den Einzelzyklus bleiben die Gesamtkosten bei Berücksichtigung der heutigen Schwangerschaftsraten in einer akzeptablen Relation.
aus "Bremer Ärztejournal" Heft 10/98 © E.H. Schmidt, O. Drost
Literatur erhältlich bei den Verfassern
Bremer Zentrum für Fortpflanzungsmedizin
Prof. Dr. med. Ernst Heinrich Schmidt und
Dr. med. Olaf Drost
Frauenklinik, Evang. Diakoniekrankenhaus
gGmbH Bremen
Gröpelinger Heerstraße 406 / 408
28239 Bremen
Tel. (0421) 61 02-0, Fax (0421) 61 02-1229
